|
e-mail: Список
электронных публикаций Список цитирований работ В.Н. Мухина |
Мухин Валерий Николаевич Личный сайт |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Мухин В. Н., Яковлев Н. М., Клименко В. М. Связь вариабельности
сердечного ритма с уровнем активации лобной коры // Российский физиологический
журнал им. И. М. Сеченова. 2011. Т. 97. № 11. С. 1281-1288. СВЯЗЬ ВАРИАБЕЛЬНОСТИ СЕРДЕЧНОГО РИТМА С УРОВНЕМ АКТИВАЦИИ
ЛОБНОЙ КОРЫ В. Н. Мухин, Н. М. Яковлев, В. М. Клименко
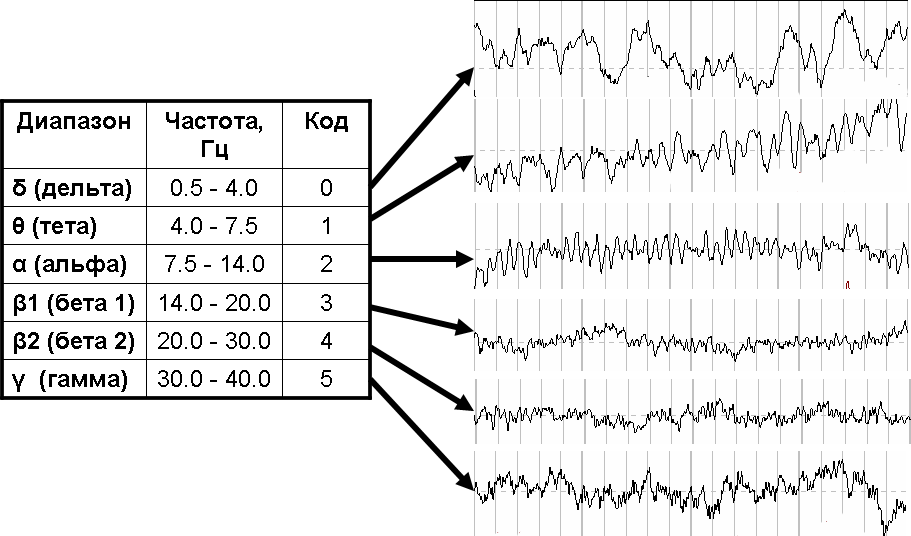
Literature data and results of our own research suggest that amplitude of periodic modulations of heart rate may be related to the cerebral cortex activity. Verification of this assumption accomplished by searching for correlation between the heart rate periodogram (as a measure of amplitude of periodic modulations of heart rate at different frequency), and electroencephalographic evaluation of the level of the different cortical areas activation. Positive association between levels of activation of the frontal cortex and amplitude of heart rate modulation with the period of 3 modulations per heart rate interval was discovered. Данные литературы и результаты собственных исследований заставляют предполагать, что амплитуда периодических модуляций сердечного ритма связана с уровнем активации коры больших полушарий. Проверка этого предположения осуществлена путём поиска корреляционной взаимосвязи между периодограммой сердечного ритма (показатель амплитуды периодических модуляций сердечного ритма различной частоты) и электроэнцефалографической оценкой уровня активации различных областей коры. Результаты исследования свидетельствуют о положительной связи амплитуды модуляций сердечного ритма, имеющих период около 3 колебаний на кардиоинтервал, с уровнем активации лобной коры. С одной стороны, лобная кора – важнейший субстрат психической работоспособности, как одного из проявлений высшей нервной деятельности. Например, по данным функциональной МРТ при выполнении сложных моторных и ментальных задач, связанных с существенной активацией когнитивных функций активируется участок лобной коры (премоторная зона, поле Бродмана 6) [2; 3]. С другой стороны, один из участков лобной коры модулирует активность бульбарного центра регуляции по принципу центральной команды [4]. Например, при ментальных и при физических нагрузках происходит уменьшение кровотока в средней лобной извилине (поле Бродмана 8), ассоциированное с увеличением частоты сердечных сокращений [5]. И, наконец, самый существенный довод в пользу этой гипотезы состоит в том, что не только средняя ЧСС, но и изменения мощности спектра сердечного ритма связаны с индуцированной эмоциями активацией кровотока (фМРТ) в медиальной префронтальной коре [6]. Частотная зона вариабельности сердечного ритма, в которой наблюдаются эти изменения, включает частоту 0,33 кол/ки («стандартная» зона HF 0,15 -- 0,40 Гц). Известно, что активность различных образований мозга подвержена влиянию неспецифических систем активации и деактивации [Реакция активации заключается в том, что в ответ на новизну раздражителей и неопределённость ситуации происходит неспецифическая активация мозга, которая обеспечивает состояние готовности мозга к ответу. Она сопровождается генерализованной десинхронизацией электрической активности мозга (повышением частоты и снижением амплитуды колебаний потенциала) во всех отведениях. При этом наблюдаются различные вегетативные феномены, в частности, учащение сердечного ритма. Реакция осуществляется одной из неспецифических систем мозга -- ретикулярной системой активации, норадренергические терминали которой имеют очень широкое поле проекции, включая новую кору. Противоположная реакция -- реакция инактивации -- осуществляется серотонинергическими нейронами ядер шва, имеющими проекции в коре и в ретикулярной системе активации. Инактивация происходит при переходе к состоянию сна]. Лобная кора и другие структуры, влияющие на сердечный ритм, -- не исключение: частота сердечных сокращений связана с реакциями активации (arousal reaction) и деактивации [7; 8; 9; 10]. Исходя из этого можно предположить, что предполагаемая связь обусловлена активностью неспецифических систем, приводящей к генерализованной активации коры, включая и лобную. Однако, возможен и другой вариант: активность лобной коры связана с вариабельностью сердечного ритма независимо от состояния неспецифических систем активации. Цель исследования -- проверить предположение о связи амплитуды периодических модуляций сердечного ритма с уровнем активации коры больших полушарий. Контингент и методы. Взаимосвязь вариабельности сердечного ритма с уровнем активации мозга оценивалась путём корреляционного анализа, в котором выступали с одной стороны -- уровень десинхронизации ЭЭГ в отдельных отведениях, а с другой --значения периодограммы сердечного ритма на различных частотах. Для этого у 33 добровольцев мужского пола в возрасте от 14 до 17 лет произведена одновременная регистрация биоэлектрической активности мозга и сердечного ритма с помощью электроэнцефалографа «Мицар-ЭЭГ». Во время регистрации испытуемые пребывали в состоянии относительного покоя в положении сидя с закрытыми глазами. Регистрация сердечного ритма производилась электрокардиографически. Автоматическая идентификация и классификация каждого комплекса QRS подтверждена визуально в соответствии с рекомендациями международной рабочей группы [11]. Участки записи, на которых выявлены нарушения ритма и проводимости, исключены из анализа. Из оставшихся участков выделены непрерывные, равные между собой ряды по 300 RR-интервалов каждый. Анализ вариабельности сердечного ритма заключался в частотном анализе этих рядов. С помощью численного преобразования Фурье получена периодограмма сердечного ритма: определены 150 (N/2=300/2=150) гармоник колебаний RR-интервалов в диапазоне частот от 0 до 0,5 колебаний на кардиоинтервал (кол/ки) и с шагом в 1/300 кол/ки. Значения периодограммы на каждой из 150 частот логарифмически преобразованы, что позволило нормализовать их распределение. Оценка уровня активации мозга производилась электроэнцефалографически. Одновременно с записью электрокардиограммы выполнена регистрация ЭЭГ-потенциалов в шести монополярных симметричных отведениях: двух лобных -- Fp1, Fp2, двух теменных -- C3, C4 и двух затылочных -- O1 и O2. При этом референтный электрод и электрод заземления располагались на мочках ушей. Полученные записи обработаны полосовым фильтром 0,3 -- 30,0 Гц. На участке электроэнцефалограммы, соответствующем по времени взятому в анализ участку записи сердечного ритма, определяли среднюю спектральную плотность мощности осцилляций ЭЭГ-потенциала в общепринятых частотных диапазонах (рис. 1). Для этого анализируемый участок электроэнцефалограммы был разделён на сегменты по 2 мс каждый (эпоха анализа). Для каждого из них выполнено прямое численное преобразование Фурье. Полученные в результате периодограммы использовались для вычисления средней арифметической для каждой из частот.
Показателем активации мозга служил уровень десинхронизации биоэлектрической активности мозга. Для определения уровня предварительно произведена стандартизация значений спектральной плотности ЭЭГ отдельно по каждому из диапазонов. В табл. 1 приведены использованные при этом параметры распределения. Способ оценки уровня десинхронизации ЭЭГ у испытуемого состоял в том, что для каждого отведения определяли диапазон, в котором стандартизованное значение мощности максимально. Код этого диапазона (рис. 1) отражал уровень десинхронизации ЭЭГ в порядковой шкале по шести градациям: от 0 до 5.
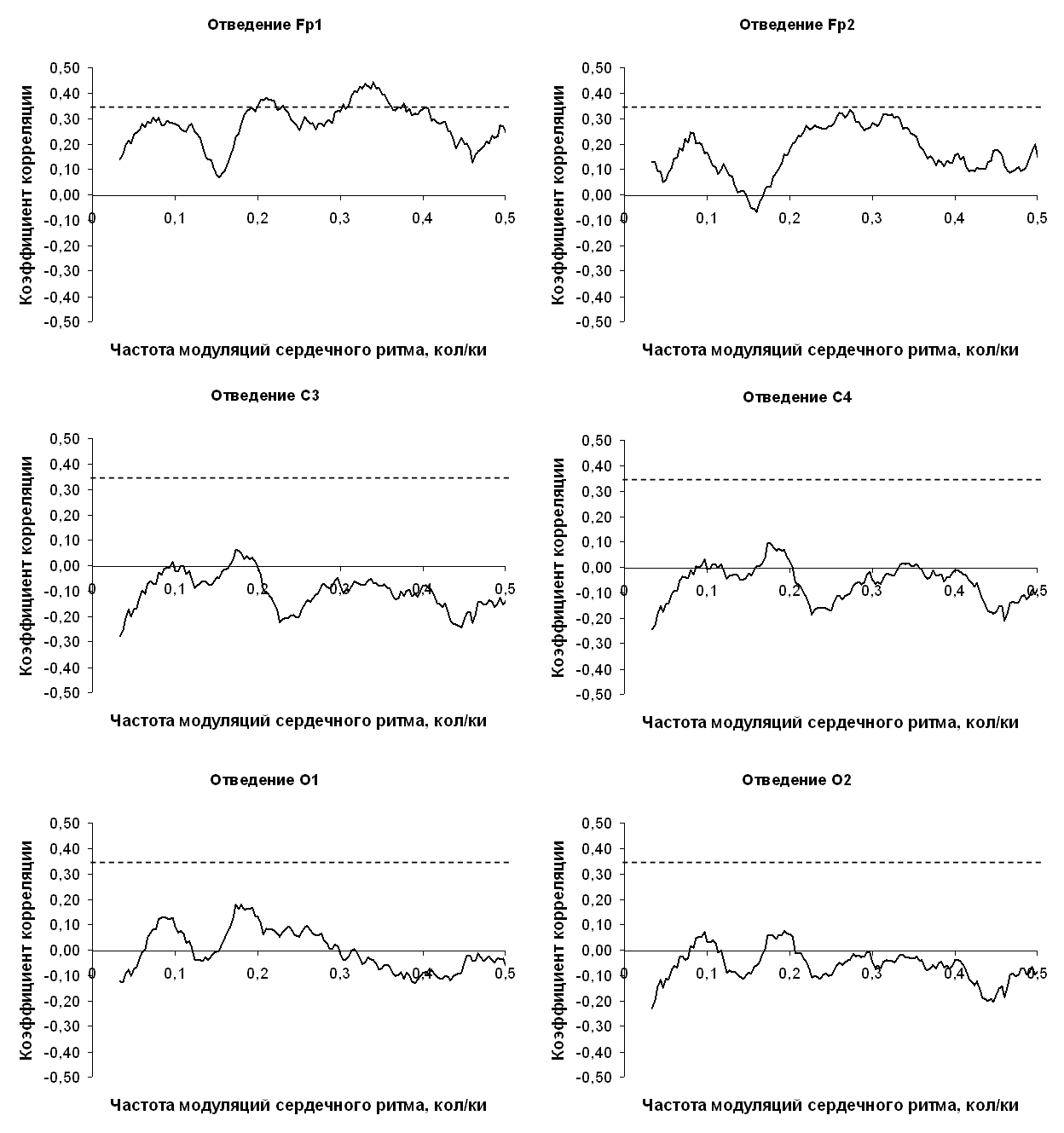
Результаты. Выявлена заметная корреляционная связь между периодограммой сердечного ритма и уровнем десинхронизации ЭЭГ в левом лобном отведении (отведение Fp1). На диаграмме зависимости коэффициента корреляции от частоты периодограммы (рис. 2) видны две волны постепенного увеличения и последующего уменьшения тесноты связи, которые превышают уровень достоверности 0,05: одна -- в частотном диапазоне 0,30-0,35 с максимальным значением коэффициента корреляции (0,54) на частоте 0,33 кол/ки, а другая -- в частотном диапазоне 0,18-0,22 с максимальноым значением коэффициента корреляции (0,47) на частоте 0,2 кол/ки.
Кроме того, для первого из этих диапазонов имеется также тенденция к достоверной корреляции (p=0,1, r=0,29) и для уровня десинхронизации в правом лобном отведении. Для теменных и затылочных отведений подобной взаимосвязи не выявлено. Итак, связь амплитуды периодических модуляций сердечного ритма с генерализованной активацией мозга выявить не удалось. Однако локальная активация лобной коры имеет положительную связь с амплитудой периодических модуляций сердечного ритма с периодом 3 кардиоинтервала (частота 0,33 кол/ки). Эти выводы подтверждают и результаты факторного анализа (табл. 2). В него включены следующие переменные: значения периодограммы в диапазоне частот, амплитуда модуляций сердечного ритма в котором связана с десинхронизацией ЭЭГ, уровень десинхронизации ЭЭГ в каждом из 6-и используемых отведений, а также средняя частота сердечных сокращений, наблюдавшаяся вовремя исследования. Метод главных компонент позволил извлечь два фактора собственные значения которых больше 1. Таблица 2. Результаты факторного анализа.
Примечание: жирным шрифтом выделены факторные нагрузки, вероятность ошибки для которых меньше 0,05 (критическая величина факторной нагрузки при N=33 и p=0,05 равна 0,34). Фактор 1 (54 % общей дисперсии) имеет значимые факторные нагрузки (R > 0,34, p <= 0,05) для следующих переменных: уровень десинхронизации ЭЭГ в лобных отведениях (в левом лобном отведении – больше) и амплитуда периодических модуляций сердечного ритма в частотном диапазоне 0,30 -- 0,35 кол/ки. Вероятнее всего, этот фактор отражает физиологические механизмы локальной активации лобной коры и показывает их положительную связь с амплитудой периодических модуляций сердечного ритма в указанном диапазоне. Фактор 2 (19 % общей дисперсии) имеет значимые факторные нагрузки для уровня десинхронизации ЭЭГ во всех шести используемых нами отведениях. Очевидно, что этот фактор связан с генерализованной активацией мозга. Отсутствие значимых факторных нагрузок по этому фактору для периодограммы сердечного ритма подтверждает отсутствие связи между генерализованной активацией мозга и амплитудой периодических модуляций сердечного ритма. Отрицательная корреляция фактора 1 со средней частотой сердечных сокращений свидетельствует о том, что физиологический механизм, связанный с локальной активацией лобной коры, модулирует сердечный ритм через парасимпатический «канал» регуляции, приводя к периодическому (с частотой 0,30-0,35 кол/ки) замедлению сердечного ритма. Результаты исследования отчасти раскрывают структурно-функциональную основу выявленной ранее взаимосвязи амплитуды модуляций сердечного ритма на частоте 0,3 колебаний на кардиоинтервал с психической работоспособностью [1]. Становится ясно, что её элемент -- активация лобной коры. Об этом свидетельствует корреляционная связь между амплитудой ассоциированных с психической работоспособностью модуляций сердечного ритма и уровнем активации лобной коры. С другой стороны, результаты исследования позволяют уточнить, что с активацией лобной коры связан не весь высокочастотный диапазон HF (0.15 -- 0.40 Гц) [6], а лишь его часть -- 0,3 -- 0,35 кол/ки. Результаты исследования согласуются с имеющимися в литературе представлениями об отрицательном хронотропном влиянии лобной коры, реализующимся по принципу центральной команды. Например, известно, что во время психической и физической работы происходит деактивация средней лобной извилины (поле Бродмана 8) (фМРТ), ассоциированная с увеличением частоты сердечных сокращений и среднего артериального давления [5]. Значит, верно и обратное: активация префронтальной коры связана с уменьшением частоты сердечных сокращений, что проявляется в состоянии покоя. Кроме того, в литературе показано, что медиальная префронтальная кора вовлечена в выученное замедление сердечного ритма при выработке классического условного рефлекса у кроликов: экспериментальное повреждение медиальной префронтальной коры приводит к уменьшению выученной условно-рефлекторной брадикардии [12; 13]. При этом, во время рефлекторного ответа увеличивается нейрональная активность в медиальной префронтальной коре животных [14; 15; 16; 17]. Тот вывод, что обнаруженная взаимосвязь реализуется через нерв-депрессор лежит в рамках общепринятых представлений о том, что передаточным звеном в реализации периодических модуляций сердечного ритма, имеющих частоту выше 0,1 Гц, являются парасимпатические волокна блуждающего нерва, который функционируют подобно низкочастотному фильтру по отношению к модулирующим сердечный ритм влияниям мозга. Например, раздражение блуждающего нерва у собак на уровне зубчатого ганглия показало, что через этот нерв осуществляется модуляция сердечного ритма выше 0,1 Гц [18]. Парасимпатическая блокада атропином уменьшает амплитуду периодических модуляций сердечного ритма больше 0,15 Гц у животных и людей, а амплитуда модуляций меньше 0,15 Гц при этом не меняется [19; 20; 21; 22]. Напротив, симпатическая блокада пропранололом не влияет на модуляции сердечного ритма больше 0,15 Гц, уменьшая при этом только модуляции меньше 0,15 Гц [19; 18; 23]. Поскольку связь периодического компонента вариабельности
сердечного ритма с генерализованной активацией коры выявить не удалось,
можно предположить, что, изменения вариабельности сердечного ритма,
наблюдающиеся в состоянии бодрствования, не связаны напрямую с функционированием
неспецифических систем активации мозга: восходящей ретикулярной активирующей
системой и системой ядер шва. Заключение. Локальная активация лобной коры (особенно слева) связана с увеличением амплитуды периодических замедлений сердечного ритма частотой около 0,3 колебаний на кардиоинтервал. Предположительно, указанная связь реализуется через парасимпатическую часть бульбарного центра. Связь амплитуды периодических модуляций сердечного ритма с уровнем общей активации мозга не выявлена. Список литературы. 1. Мухин В. Н., Клименко В. М. Состояние мобилизационной готовности и частотная структура вариабельности сердечного ритма. Российский физиологический журнал им. И. М. Сеченова. 95 (4): 367-375. 2009. 2. Haier R., Karama S., Leyba L., Jung R. MRI assessment of cortical thickness and functional activity changes in adolescent girls following three months of practice on a visual-spatial task. BMC Research Notes. 2 (174). 2009. doi:10.1186/1756-0500-2-174 3. Hanakawa T., Honda M., Sawamoto N., Okada T., Yonekura Y., Fukuyama H., Shibasaki H. The role of rostral Brodmann area 6 in mental-operation tasks: an integrative neuroimaging approach. Cerebral Cortex (New York, N.Y.: 1991). 12 (11): 1157-1170. 2002. 4. Goodwin G. M., McCloskey D. I., Mitchell J. H. Cardiovascular and respiratory responses to changes in central command during isometric exercise at constant muscle tension. The Journal of Physiology. 226 (1): 173-190. 1972. 5. Critchley H. D., Corfield D. R., Chandler M. P., Mathias C. J., Dolan R. J. Cerebral correlates of autonomic cardiovascular arousal: a functional neuroimaging investigation in humans. The Journal of Physiology. 523 (1): 259-270. 2000. 6. Lane R. D., McRae K., Reiman E. M., Chen K., Ahern G. L., Thayer J. F. Neural correlates of heart rate variability during emotion. NeuroImage. 44 (1): 213-222. 2009. 7. Steriade M. Arousal: revisiting the reticular activating system. Science. 272 (5259): 225-226. 1996. 8. Delmonte M. M. Physiological responses during meditation and rest. Biofeedback and Self-Regulation. 9 (2): 181-200. 1984. 9. Morse D. R., Martin J. S., Furst M. L., Dubin L. L. A physiological and subjective evaluation of meditation, hypnosis, and relaxation. Psychosomatic Medicine. 39 (5): 304-324. 1977. 10. Benson H., Beary J. F., Carol M. P. The relaxation response. Psychiatry. 37 (1): 37-46. 1974. 11. Heart rate variability: standards of measurement, physiological interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Circulation. 93 (5): 1043-1065. 1996. 12. Frysztak R. J., Neafsey E. J. The effect of medial frontal cortex lesions on cardiovascular conditioned emotional responses in the rat. Brain Research. 643 (1-2): 181-193. 1994. 13. Buchanan S.L., Powell D.A. Cingulothalamic and prefrontal control of autonomic function. Neurobiology of cingulate cortex and limbic thalamus: A comprehensive handbook. Boston: Birkhauser, 1993. PP. 381-414 14. Maxwell B., Powell D. A., Buchanan S. L. Multiple- and single-unit activity in area 32 (prelimbic region) of the medial prefrontal cortex during Pavlovian heart rate conditioning in rabbits. Cerebral Cortex (New York, N.Y.: 1991). 4 (3): 230-246. 1994. 15. Gibbs C. M., Prescott L. B., Powell D. A. A comparison of multiple-unit activity in the medial prefrontal and agranular insular cortices during Pavlovian heart rate conditioning in rabbits. Experimental Brain Research. Experimentelle Hirnforschung. Expérimentation Cérébrale. 89 (3): 599-610. 1992. 16. Gibbs C. M., Powell D. A. Single-unit activity in the dorsomedial prefrontal cortex during the expression of discriminative bradycardia in rabbits. Behavioural Brain Research. 43 (1): 79-92. 1991. 17. Gibbs C. M., Powell D. A. Neuronal correlates of classically conditioned bradycardia in the rabbit: studies of the medial prefrontal cortex. Brain Research. 442 (1): 86-96. 1988. 18. Berger R. D., Saul J. P., Cohen R. J. Transfer function analysis of autonomic regulation. I. Canine atrial rate response. American Journal of Physiology - Heart and Circulatory Physiology. 256 (1): H142 -H152. 1989. 19. Saul J. P., Berger R. D., Albrecht P., Stein S. P., Chen M. H., Cohen R. J. Transfer function analysis of the circulation: unique insights into cardiovascular regulation. The American Journal of Physiology. 261 (4 Pt 2): H1231-1245. 1991. 20. Parati G., Saul J. P., Rienzo M. Di, Mancia G. Spectral analysis of blood pressure and heart rate variability in evaluating cardiovascular regulation. A critical appraisal. Hypertension. 25 (6): 1276-1286. 1995. 21. Eckberg D. L. Human sinus arrhythmia as an index of vagal cardiac outflow. Journal of Applied Physiology: Respiratory, Environmental and Exercise Physiology. 54 (4): 961-966. 1983. 22. Katona P. G., Jih F. Respiratory sinus arrhythmia: noninvasive measure of parasympathetic cardiac control. Journal of Applied Physiology. 39 (5): 801-805. 1975. 23. Saul J. P., Berger R. D., Chen M. H., Cohen R. J. Transfer function analysis of autonomic regulation. II. Respiratory sinus arrhythmia. American Journal of Physiology - Heart and Circulatory Physiology. 256 (1): H153 -H161. 1989. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||